У медичних університетах більшості країн світу при підготовці лікарів сучасного міжнародного рівня є обов’язковим вивчення основ молекулярної біології для більш глибокого розуміння механізмів виникнення та розвитку патологічних процесів в організмі людини, а також для пошуку шляхів їх подолання, розробки нових стратегій створення високоефективних лікарських препаратів з високою специфічністю та без побічних ефектів. Це обумовлено насамперед тим, що регуляція основних метаболічних процесів як у нормі, так і за різноманітних патологій опосередковується репрограмуванням функціональної активності геному на рівні різних сигнальних систем клітини.
Таким чином, молекулярна біологія надає знання про молекулярно-генетичні основи підтримання гомеостазу та молекулярні механізми розвитку метаболічних порушень за різноманітних патологій, зокрема, таких, як онкологічні, серцево-судинні, ендокринні та інші, а також вказує на можливі шляхи їх подолання, а тому детальне вивчення цієї науки має надзвичайно важливе значення для підготовки лікарів високої кваліфікації міжнародного рівня.
За останні десятиліття досягнуті фантастичні успіхи у вивченні структурно-функціональної організації геному людини, а також у з’ясуванні молекулярно-генетичних механізмів регуляції різних метаболічних процесів як у нормі, так і за різноманітних патологічних станів, які відкривають нові можливості для розуміння причин виникнення і розвитку захворювань та їх метаболічних і неметаболічних ускладнень, а також для профілактики і лікування.
Численними дослідженнями встановлено, що геном людини містить інформацію для синтезу великої кількості різних за своїм розміром і функцією рибонуклеїнових кислот (РНК), які є необхідними для створення апарату синтезу білків (рибосомні та транспортні РНК; рРНК та тРНК), РНК, які кодують синтез білків (матричні РНК; мРНК), у тому числі й рибосомних білків (протеїнів) та аміноацил-тРНК-синтетаз, а також численну групу великих і малих за розміром некодуючих РНК, які відіграють надзвичайно важливу роль у регуляції експресії генів (рівня мРНК та протеїнів). До некодуючих РНК належать великі некодуючі РНК (внкРНК; lncRNA), малі ядерні РНК (мяРНК; snRNA), циркулярні РНК (circRNA) та мікроРНК (міРНК; miRNA), причому кількість цих РНК вимірюється десятками тисяч видів.

Вивчення структури та функції рРНК, тРНК та мРНК, що кодують рибосомні протеїни, аміноацил-тРНК-синтетази й низку інших асоційованих з функцією рибосом протеїнів, а також мутацій у генах, що їх кодують, має надзвичайно важливе значення для розуміння молекулярних механізмів протеїнового синтезу в нормі та за різних патологій, у тому числі й механізмів чутливості та стійкості до антибіотиків, як і до низки лікарських препаратів. Невелика частина мРНК транслюється на рибосоми, що не пов’язані з ендоплазматичним ретикулумом, але більша частина рибосом є прикріпленою до ендоплазматичного ретикулума, ще не до кінця з’ясованими механізмами і переважна більшість протеїнів у клітині синтезується саме на таких рибосомах шляхом трансляції мРНК (рисунок 1). Обумовлено це тим, що синтезовані на прикріплених рибосомах поліпептиди мають перейти до люмену ендоплазматичного ретикулума для подальшої їх пост-трансляційної модифікації і формування третинної структури зрілого протеїну, причому тут же відбувається й чіткий контроль правильності створеної третинної структури, а неправильно згорнуті протеїни негайно знищуються спеціальною системою деградації ERAD.
Роботи з вивчення структури та функцій рибосом й оригінальні структурні відкриття у сфері механізму роботи рибосом та синтезу протеїнів у живих клітинах були високо оцінені і троє вчених (Венкатраман Рамакрішнан, Томас Стейц та Ада Йонат були відзначені Нобелівською премією з хімії за 2009 рік. Ці дослідження пролили світло на механізми дії антибіотиків, зокрема, їх дії на функцію рибосом, а також на причини розвитку резистентності до них, були важливим кроком у процесі вивчення клінічної ефективності лікарської терапії та надали раціонального конструювання новим антибіотикам.
Іншим важливим досягненням молекулярної біології та молекулярної медицини є відкриття і детальне вивчення ролі стресу ендоплазматичного ретикулума в нормі та за різноманітних патологій, як одного з найважливіших механізмів підтримання гомеостазу. За умов тривалого порушення умов гомеостазу внаслідок дії різноманітних чинників спостерігається накопичення в ендоплазматичному ретикулумі неправильно згорнутих протеїнів у результаті змін в активності ензимів, що контролюють посттрансляційну модифікацію протеїнів. Саме цей стан і прийнято називати стресом ендоплазматичного ретикулума. За умов стресу активуються три сенсорно-сигнальні системи ендоплазматичного ретикулума (PERK, IRE1 та ATF6), які генерують і передають сигнали з ендоплазматичного ретикулума до цитоплазми, рибосом, мітохондрій та ядра, блокуючи синтез основної маси протеїнів і активуючи синтез лише тих протеїнів, що необхідні для виходу зі стресового стану, знищення неправильно згорнутих протеїнів та відновлення гомеостазу.
Стрес ендоплазматичного ретикулума є необхідним компонентом системи контролю біосинтезу інсуліну та низки інших пептидних гормонів. Підвищений рівень глюкози є індуктором цього стресу в бета-клітинах, що призводить до пригнічення синтезу основної маси протеїнів і посиленого синтезу інсуліну відносно невеликою кількістю бета-клітин для всього організму та зниженню рівня глюкози. А це є стоп-сигналом для синтезу інсуліну. Разом з тим стрес ендоплазматичного ретикулума є важливим фактором розвитку та резистентності до інсуліну й метаболічних захворювань, а тому пізнання детальних молекулярних механізмів резистентності до інсуліну, як і до інших пептидних гормонів, зокрема до лептину, є надзвичайно важливим для профілактики й лікування метаболічних захворювань, у тому числі й діабету 2 типу, який невпинно прогресує у всьому світі.
Абсолютно залежними від стресу ендоплазматичного ретикулума є злоякісні пухлини, для яких цей стрес є необхідним фактором їх росту та виживання внаслідок репрограмування геному та позбавлення негативних впливів як цього стресу, так і гіпоксії. І заслуга в розшифруванні цих механізмів належить молекулярним біологам, які зробили дуже багато відкриттів при вивченні структури, функції та механізмів регуляції експресії генів, у тому числі й за стресу ендоплазматичного ретикулума. Саме цей стрес забезпечує злоякісним пухлинам експресію тих генів, які є відповідальними за ангіогенез, посилення процесів проліферації, метастазування та пригнічення апоптозу, виключення туморсупресорних генів і контроль багатьох інших асоційованих з пухлинним ростом процесів, зокрема гіпоксії. Гіпоксія в злоякісних пухлинах переважно не абсолютна, а відносна, функціональна. В пухлинних клітинах генеруються сигнали, що обумовлюють знижену інтенсивність споживання кисню для активації гліколізу та проліферативних процесів, а, можливо, й деяких інших, зокрема репрограмування функції мітохондрій. Більше того, саме поява стресу ендоплазматичного ретикулума в пухлинних клітинах обумовлює розвиток резистентності до хіміотерапії. Все це вказує на складний процес репрограмування геному в злоякісних пухлинах, причому не лише тих генів, що кодують синтез онкогенів, пухлинних супресорів, протеїнкіназ і протеїнфосфатаз, протеаз та рибонуклеаз, а й некодуючих РНК, зокрема мікроРНК, циркулярних РНК і великих некодуючих РНК. Було також виявлено, що стрес ендоплазматичного ретикулума контролює роботу генів біологічного годинника добових ритмів (circadian clock). У пухлинних клітинах цей стрес ще не з’ясованими механізмами вимикає його роботу від центрального, перепрограмує на «самостійну» роботу, що можливо значною мірою та забезпечує посилений ріст пухлинних клітин.
Ідентифікація генів, що кодують білкові компоненти біологічного годинника добових ритмів, та з’ясування молекулярних механізмів його роботи через петлю негативного оберненого зв’язку транскрипції-трансляції є ще одним прикладом великих досягнень молекулярної біології та біохімії, що були відзначені також Нобелівською премією з фізіології або медицини в 2017 році: нагороду отримали Джефрі Голл і Майкл Росбаш. Добовий біологічний годинник є «вартовим» гомеостазу, оскільки контролює циклічний характер перебігу різноманітних процесів у клітинах, але у випадку «надзвичайних ситуацій», зокрема стресу ендоплазматичного ретикулума, «передає владу» в його руки, про що було вказано вище. Відомо, що порушення біологічних ритмів може призводити до розвитку багатьох хвороб, зокрема метаболічних та онкологічних.
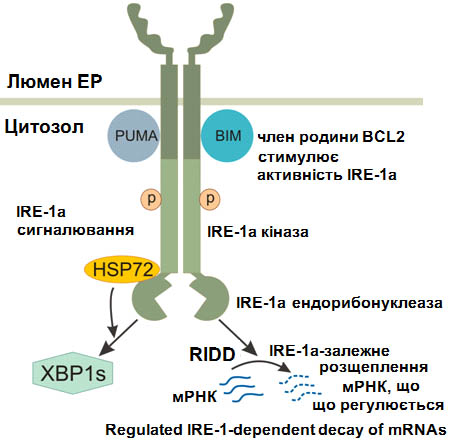
На основі молекулярно-біологічних даних про роль стресу ендоплазматичного ретикулума були розроблені нові стратегії пригнічення росту злоякісних пухлин шляхом інгібування одного із сенсорно-сигнальних шляхів стресу ендоплазматичного ретикулума, а саме IRE1 (від ендоплазматичного ретикулума до ядра 1), який має протеїнкіназну та ендорибонуклеазну активності та через які контролює експресію тисяч генів. На рисунку 2 представлено схематичне зображення цього сигнального шляху, який має протеїнкіназну та ендорибонуклеазну активності й через які контролює експресію генів різними механізмами для виходу зі стресового стану, для відновлення гомеостазу.
Сенсорно-сигнальний ензим IRE1 контролює експресію великої кількості генів, які мають відношення до регуляції процесів метаболізму, проліферації, апоптозу та ангіогенезу. Він є обов’язковим компонентом злоякісного росту, а тому повне виключення функції IRE1 сигнального шляху в клітинах гліоми та аденокарциноми легень призводило до зменшення рівня експресії проангіогенних та пропроліферативних факторів, а також посиленню експресії пухлино-супресорних і проапоптотичних факторів, що вносить суттєвий вклад у пригнічення росту пухлин з цих клітин. Разом з тим пригнічення лише ендорибонуклеазної активності сигнального ензиму IRE1 має значно більший протипухлинний ефект і, відповідно, інший характер змін в експресії ключових регуляторних факторів та ензимів, що контролюють процеси проліферації. Більше того, пригнічення ендорибонуклеазної активності IRE1 значно посилює чутливість до хіміотерапії. Таким чином, пригнічення ендорибонуклеазної активності сигнального ензиму IRE1 є важливим фактором пригнічення росту злоякісних пухлин, але такого роду протипухлинна дія має бути спрямована лише на пухлинні клітини, оскільки в нормальних клітинах функціональна цілісність систем стресу ендоплазматичного ретикулума є необхідною умовою збереження гомеостазу та здоров’я.
Важливим досягненням функціональної молекулярної біології та молекулярної медицини було з’ясування молекулярно-генетичних механізмів відчуття клітинами кисню і включення механізмів подолання дефіциту кисню як за фізіологічних, так і патофізіологічних умов, зокрема в злоякісних пухлинах, при травмах, інфарктах та інсультах. Згідно з рішенням Нобелівського комітету Нобелівською премією з фізіології або медицини 2019 року нагороджені троє видатних вчених, які зробили найбільший внесок у вияснення молекулярних механізмів відповіді клітин на гіпоксію, що має велике практичне значення для медицини. Це – Грег Семенза, Пітер Раткліфф і Вільям Кейлін. Г. Семенза виділив залежну від гіпоксії субодиницю транскрипційного фактора HIF, ідентифікував ген, що її кодує, і показав, разом з іншими вченими, її участь у реакції клітин на гіпоксію, а також можливе практичне значення цих досліджень. Протеїн HIF є транскрипційним фактором, який трансактивує експресію генів, що кодують синтез протеїнів, залучених у реакціях адаптації до гіпоксії, зокрема тих протеїнів, які контролюють метаболізм глюкози, васкуляризацію та проліферацію клітин. Вільям Кейлін продемонстрував, що протеїн VHL (Von Hippel-Lindau tumor suppressor protein) негативно причетний до прояву гіпоксичних реакцій. Пітер Раткліфф продемонстрував яким чином HIF1а поєднаний з VHL у механізмах реакції клітин на гіпоксію, дослідив роль пролілгідроксилаз HIF1а (PHD ензими) в цих процесах, показавши, що саме пролілгідроксилаза HIF1а є сенсором кисню, який активує ці ензими разом з іонами заліза. Описані вище відкриття цих трьох нобелівських лауреатів узагальнені на рисунку 3.

За наявності кисню альфа субодиниця HIF підлягає убіквітинації та протеасомній деградації, але для ініціації убіквітинації альфа субодиниці HIF необхідні пролілгідроксилаза HIF1а та протеїн VHL, причому саме пролілгідроксилаза, як сенсор кисню та її активатор, вносить «чорні» мітки в альфа субодиницю HIF. Відомо, що є три різних гени, які кодують різні за своїми властивостями альфа субодиниці HIF. Пролілгідроксилази альфа субодиниці HIF активуються не лише киснем, а й іонами заліза, за відсутності яких цей ензим не проявляє активності навіть за умов наявності кисню. Як видно з рисунка 3, за наявності кисню PHD ензим гідрокислює пролінові залишки (Р) в позиції 402 та 564 молекули HIF1a, але для цього потребує зв’язування з VHL, який є розпізнавальним компонентом Е3 убіквітин-протеїн лігази. Зв’язування VHL активується також ацетилуванням залишку лізину (К) 532 ARD1 ацетилтрансферазою. Убіквітинація HIF1a призводить до його деградації 26S протеасомою. Важливо зазначити, що кисень також регулює взаємодію HIF1a з коактиваторами транскрипції. Так, залежне від кисню окислення залишку аспарагіну (N) 803 в HIF1a протеїном HIF1AN/FIH1 (фактор інгібуючий HIF-1) блокує зв’язування р300 і СВР з HIF1a і таким чином інгібує опосередковану транскрипційним фактором HIF транскрипцію генів.
Відкриття убіквітин-залежного протеолізу, тобто ролі убіквітину в клітинній системі деградації білків у протеосомах, Агароном Чехановером разом з Аврагамом Гершком та Ірвіном Роузом було також відзначено Нобелівською премію з хімії 2004 року.
Водночас за умов гіпоксії швидкість окислення проліну та аспарагіну в HIF1a різко знижується і VHL не може зв’язатися з ним та ініціювати убіквітинацію та деградацію. Разом з тим фактори активації транскрипції р300 та СВР можуть зв’язуватися з HIF1a, оскільки аспарагін не гідрокислюваний, і таким чином відбувається активація транскрипції залежних від HIF1a генів. Ці результати справді мають велике практичне значення для медицини, оскільки чітко вказують на шляхи пригнічення росту злоякісних пухлин, відновлення постінфарктних і постінсультних тканин, а також лікування анемії та деяких інших патологій.
Розвиток молекулярно-біологічних досліджень сприяв також з’ясуванню механізмів стійкості до антибіотиків і створенню нових, більш ефективних антибіотиків. Відомо, що такі важливі класи антибіотиків, як макроліди, тетрацикліни, аміноглікозіди та оксазолідинони, проявляють антибактеріальну дію, впливаючи на рибосомні субодиниці шляхом інгібування біосинтезу білка, взаємодіючи з центрами ініціації, елонгації та термінації трансляції, а це є ефективним підходом для боротьби з бактеріальними інфекціями. Так, тетрациклін перешкоджає утворенню комплексу тРНК з рибосомою, зупиняючи таким чином синтез протеїнів. Хлорамфенікол (левоміцетин) інгібує пептидилтрансферазу бакте-ріальних рибосом, а циклогексімід є інгібітором елонгації трансляції мРНК на цитоплазматичних 80S рибосомах. Генетичні дефекти рибосомних протеїнів та факторів біогенезу рибосом є летальними на ранніх ембріональних стадіях розвитку вищих організмів. Більше того, порушення системи як трансляції, так і біогенезу рибосом може призводити до онкотрансформації клітин.
Яскравим прикладом великого значення вивчення експресії генів для теорії та клініки є також дослідження ролі зниження і підвищення рівня експресії гемоксігенази-1 (HMOX-1) та її активності на широкий спектр біологічних систем, а також за судинних захворювань. Так, на- декспресія HMOX-1 і збільшення її активності призводить до високого рівня білірубіну, що вимагає клінічного застосування специфічних інгібіторів активності цього ензиму, а зниження експресії та активності HMOX-1 спостерігається за ожиріння. За цього стану відбувається активація оксидативного стресу шляхом збільшення рівня білірубіну, СO та зниження рівня гему, опосередковуючи протизапальні, антиапоптотичні та прооксидантні ефекти. Але надекспресія HMOX-1 за умов ожиріння призупиняє ці процеси.

Яскравим прикладом важливого значення досягнень функціональної молекулярної біології для сучасної медицини є результати численних досліджень про молекулярно-генетичну основу виникнення й розвитку метаболічних захворювань та їх ускладнень, зокрема ожиріння, резистентності до інсуліну і діабету 2 типу. За останні десятиліття у всьому світі значно зросла кількість людей з ожирінням, у тому числі й підлітків. Ожиріння та його метаболічні ускладнення є однією із найбільш важливих медичних і соціальних проблем сьогодення, оскільки вони значною мірою обумовлені як впливом факторів довкілля і порушенням біологічних ритмів, так і функцією генів, генетично детермінованою схильністю до цієї патології. Важливість проблеми ожиріння пов’язана не стільки зі збільшенням маси тіла, скільки з розвитком різноманітних ускладнень, зокрема резистентності до інсуліну та діабету 2 типу. Останнім часом особливе значення в розвитку ожиріння у дітей приділяють структурі ліпідних компонентів грудного молока та молочних сумішей для немовлят, а також дисрегуляції біологічного годинника, що контролює більшість фізіологічних і метаболічних процесів в організмі, оскільки саме від цих чинників значною мірою залежить розвиток ожиріння в подальшому житті.
Дослідженнями, які проведені на молекулярному та клітинному рівнях, встановлено, що за ожиріння відбувається функціональна перебудова геному, змінюється експресія великої кількості генів, причому не лише в жировій тканині, і в інших органах та тканинах, зростає кількість адипокінів, а також порушується рівень регуляторних мікроРНК, у тому числі й у плазмі крові. Більше того, показано, що харчові ліпіди і, зокрема, поліненасичені жирні кислоти, є потужними регуляторами експресії генів, відповідальних за метаболізм ліпідів і глюкози, та забезпечують захист організму від розвитку резистентності до інсуліну, а також ожиріння.
Важливим досягненням молекулярної біології є з’ясування молекулярних механізмів росту склеротичних бляшок через індукцію експресії генів VEGF, IL-8, COX2 та металопротеази ADAMTS1 за дії різних за структурою окиснених фосфоліпідів.
Вивчення основ молекулярної біології при підготовці лікарів сучасного міжнародного рівня має бути обов’язковим для більш глибокого розуміння механізмів регуляції основних метаболічних процесів у нормі та причин виникнення й розвитку патологічних процесів в організмі людини, а також для пошуку шляхів їх подолання, розробки нових стратегій створення лікарських препаратів, які діяли б з високою ефективністю й без ускладнень. Це обумовлено передусім тим, що регуляція основних метаболічних процесів як у нормі, так і за різноманітних патологій опосередковується репрограмуванням функціональної активності геному на рівні різних сигнальних систем клітин. Молекулярна біологія є підґрунтям для розуміння молекулярно-генетичних основ підтримання гомеостазу в організмі та молекулярних механізмів розвитку метаболічних порушень за різноманітних патологій, зокрема таких, як онкологічні, серцево-судинні, ендокринні та інші, а також чітко вказує на можливі шляхи їх подолання.
Олександр МІНЧЕНКО,
завідувач відділу молекулярної біології Інституту біохімії ім. О. В. Палладіна НАН України, доктор біологічних наук, професор
